上海博湖生物科技有限公司品牌商
9 年
手机商铺
商家活跃:
产品热度:
- NaN
- 0
- 0
- 2
- 2
推荐产品
公司新闻/正文
PCR实验干货推荐
352 人阅读发布时间:2024-04-16 14:13
PCR是聚合酶链式反应(Polymerase Chain Reaction)的简称。是一种分子生物学技术,用于放大特定的DNA片段,可看作生物体外的特殊DNA复制。通过DNA基因追踪系统,能迅速掌握患者体内的病毒含量,其精确度高达纳米级别。
一、实验原理:
PCR聚合酶链式反应,可以选择性扩增一段DNA序列,其基本步骤是,首先将待扩增的模板DNA变性使之成为单链,DNA样品中,特异性的引物能够与其互补的序列杂交,在dNTPs和Taq酶存在时,就可以合成模板DNA的互补链,反应完成后,将反应混合物加热使DNA双链变性,温度下降后,过量的引物又可以开始第二轮的合成反应。这种延伸-变性-退火-延伸的循环可以重复多次,使所需要的DNA片段得到特异性的扩增。
1. 变性:加热使模板DNA在高温下(94℃)变性,双链间的氢键断裂而形成两条单链.
2. 退火:使溶液温度降至50~60℃,模板DNA与引物按碱基配对原则互补结合.
3. 延伸:溶液反应温度升至72℃,耐热DNA聚合酶以单链DNA为模板,在引物的引导下,利用反应混合物中的4种脱氧核苷三磷酸(dNTPs),按5ˊ→3ˊ方向复制出互补DNA。
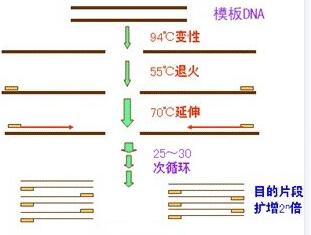
上述3步为一个循环,即高温变性、低温退火、中温延伸3个阶段。从理论上讲,每经过一个循环,样本中的DNA量应该增加一倍,新形成的链又可成为新一轮循环的模板,经过25~30个循环后DNA可扩增106~109倍。
二、典型的PCR反应体系由如下组分组成:
①、DNA模板(template):含有待扩增的DNA片段。
②、2条引物(primer):决定了需要扩增的起始和终止位置。
③、DNA聚合酶(polymerase):复制需要扩增的区域,耐高温的Taq 酶最为常见,其在DNA变性过程中仍具活性。
④、4种脱氧核苷三磷酸(dNTPs):DNA聚合酶可以从中合成新的DNA互补链。
⑤、含有镁离子的缓冲体系,提供适合聚合酶行使功能的化学环境。
三、 试剂仪器
①、试剂和缓冲液
PCR mix,10×PCR Buffer,引物,模板。
②、仪器耗材
PCR仪,掌上离心机,微量移液器,枪头,1.5mL离心管,PCR管,冰盒。
四、 实验步骤(每人一组,每人做1管,纯化时两人一组)
1. 查找基因序列,设计合成PCR引物。注意合成引物约需一周时间,请提前准备。详细步骤请参考实验一后面的附件内容。
2. 在50μL反应体系中,加入:
模板DNA (5ng/μL) 1
引物P1P2(10μmol/L) 各1
2×PCR mix 25
ddH2O 22
在冰上配制,注意混匀后离心。加入10μL石蜡油覆盖。
3. 在PCR仪中预变性94℃ 4min,然后循环:94℃ 30s,55℃ 30s,72℃ 60s,30个循环;循环结束后,72℃10min 。扩增的PCR产物4℃保存。(OC-II)
4. 取PCR产物2-5μL与上样缓冲液混合,点样。
5. 1% 琼脂糖胶电泳,160V 30-40min。
6. 电泳结束,溴化乙锭染色5-10分钟。
7. 用凝胶成像仪观察、拍照。
8. PCR产物切胶回收。步骤参见胶回收Kit说明书。
一、实验原理:
PCR聚合酶链式反应,可以选择性扩增一段DNA序列,其基本步骤是,首先将待扩增的模板DNA变性使之成为单链,DNA样品中,特异性的引物能够与其互补的序列杂交,在dNTPs和Taq酶存在时,就可以合成模板DNA的互补链,反应完成后,将反应混合物加热使DNA双链变性,温度下降后,过量的引物又可以开始第二轮的合成反应。这种延伸-变性-退火-延伸的循环可以重复多次,使所需要的DNA片段得到特异性的扩增。
1. 变性:加热使模板DNA在高温下(94℃)变性,双链间的氢键断裂而形成两条单链.
2. 退火:使溶液温度降至50~60℃,模板DNA与引物按碱基配对原则互补结合.
3. 延伸:溶液反应温度升至72℃,耐热DNA聚合酶以单链DNA为模板,在引物的引导下,利用反应混合物中的4种脱氧核苷三磷酸(dNTPs),按5ˊ→3ˊ方向复制出互补DNA。

上述3步为一个循环,即高温变性、低温退火、中温延伸3个阶段。从理论上讲,每经过一个循环,样本中的DNA量应该增加一倍,新形成的链又可成为新一轮循环的模板,经过25~30个循环后DNA可扩增106~109倍。
二、典型的PCR反应体系由如下组分组成:
①、DNA模板(template):含有待扩增的DNA片段。
②、2条引物(primer):决定了需要扩增的起始和终止位置。
③、DNA聚合酶(polymerase):复制需要扩增的区域,耐高温的Taq 酶最为常见,其在DNA变性过程中仍具活性。
④、4种脱氧核苷三磷酸(dNTPs):DNA聚合酶可以从中合成新的DNA互补链。
⑤、含有镁离子的缓冲体系,提供适合聚合酶行使功能的化学环境。
三、 试剂仪器
①、试剂和缓冲液
PCR mix,10×PCR Buffer,引物,模板。
②、仪器耗材
PCR仪,掌上离心机,微量移液器,枪头,1.5mL离心管,PCR管,冰盒。
四、 实验步骤(每人一组,每人做1管,纯化时两人一组)
1. 查找基因序列,设计合成PCR引物。注意合成引物约需一周时间,请提前准备。详细步骤请参考实验一后面的附件内容。
2. 在50μL反应体系中,加入:
模板DNA (5ng/μL) 1
引物P1P2(10μmol/L) 各1
2×PCR mix 25
ddH2O 22
在冰上配制,注意混匀后离心。加入10μL石蜡油覆盖。
3. 在PCR仪中预变性94℃ 4min,然后循环:94℃ 30s,55℃ 30s,72℃ 60s,30个循环;循环结束后,72℃10min 。扩增的PCR产物4℃保存。(OC-II)
4. 取PCR产物2-5μL与上样缓冲液混合,点样。
5. 1% 琼脂糖胶电泳,160V 30-40min。
6. 电泳结束,溴化乙锭染色5-10分钟。
7. 用凝胶成像仪观察、拍照。
8. PCR产物切胶回收。步骤参见胶回收Kit说明书。
五、注意事项
1. 进行PCR反应时,注意加入试剂的顺序。注意加入任何一种试剂后均需混匀。
2. 本实验使用2xPCR mix,包含有dNTPs和Taq酶。
3. 引物的稀释:分子量24bp*324.5 = 7788,质量数10OD*33 =33ug,摩尔数=33/7788 =4.2 nmol,母液浓度4.2 n mol / 84μL H2O = 50μmol/L,使用时取母液稀释5倍,则终浓度为10μmol/L。
4. PCR扩增产物共20μL,其中2-5 μL用于检测,剩余的用于纯化回收。
5. 使用自己的实验材料进行PCR扩增的学生,请提前准备引物和模板。